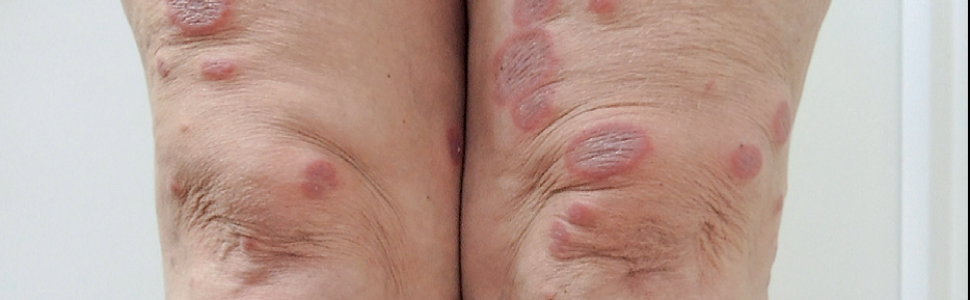
Ocenia się, że GA dotyczy około 0,1-0,4% pacjentów dermatologicznych. Obraz kliniczny choroby jest zróżnicowany. Wyróżnia się kilka postaci choroby: ograniczoną (najczęściej występującą), uogólnioną, podskórną, wrzodziejącą, rumieniową, blaszkowatą, podskórną, grudkową z pępkowatymi zagłębieniami, krostkową, linijną, destrukcyjną. Nie istnieje konsensus terapeutyczny GA, a decyzje terapeutyczne oparte są na nielicznych doniesieniach literaturowych, uwzględniających opisy przypadków lub niewielkie badania retrospektywne. Wielokrotnie podejmowane są różne terapie, nie zawsze z zadowalającym skutkiem. Dlatego leczenie GA niekiedy może być traktowane jako wyzwanie. Warto zwrócić uwagę, że w postaci ograniczonej istnieje możliwość samoistnej remisji zmian, co niekiedy przekłada się na decyzje o odstąpieniu od terapii.
Etiologia zmian nie jest do końca poznana, wydaje się, że mają charakter późnej odpowiedzi immunologicznej, indukowanej przez urazy, infekcje wirusowe, ekspozycję na promieniowanie ultrafioletowe oraz leki, takie jak allopurinol, talidomid, inhibitory TNF-α. Ponadto na podstawie analizy wyników bioptatów pobranych ze zmian GA, ostatnio stwierdzono znaczące podwyższenie poziomu zapalnych komórek T-helper typu 1 (Th1, TNF-α i interferon-γ), Th2 (IL-4) i szlaków immunologicznych kinazy Janusa. Lytvyn i wsp. dokonali przeglądu systematycznego baz danych MEDLINE i EMBASE w celu podsumowania doniesień na temat rozwoju GA u pacjentów przyjmujących leki biologiczne z powodu chorób zapalnych mediowanych immunologicznie. Po uwzględnieniu kryteriów włączenia i wyłączenia, do przeglądu zakwalifikowano 16 prac opisujących 34 przypadki. Zmiany o charakterze GA pojawiły się po rozpoczęciu stosowania leków biologicznych: anty-TNF-α, anty-IL-17, anty-IL-6, anty-IL-12/23. Początek zmian występował w okresie od 2 tygodni do 6 lat od rozpoczęcia terapii, w przypadku anty-TNF-α, anty-IL-17A i anty-IL-6 wynosił odpowiednio 15,9 miesiąca, 2,9 miesiąca i 4,5 miesiąca. W 20 przypadkach doszło do remisji klinicznej, przy czym w 80% była to remisja całkowita, a w 4 częściowa. Wśród tych pacjentów, u 7 osób dołączono miejscowe glikokortykosteroidy, nie przerywając leczenia biologicznego, u 3 miejscowemu leczeniu towarzyszyło odstawienie leku biologicznego, u 2 zmieniono lek biologiczny, u 1 przerwano leczenie biologiczne i wdrożono doustne glikokortykosteroidy, u 1 pacjenta zastosowano miejscowe glikokortykosteroidy, nie opisując ewentualnej zmiany w terapii biologicznej. Ponadto u jednego pacjenta z nawracającymi zmianami GA, odstawienie leku i doustna glikokortykosteroidoterapia doprowadziły do całkowitej remisji klinicznej. Średni okres czasu od momentu pojawienia się GA do całkowitej poprawy wynosił 3,1 miesiąca. Na podstawie analizy piśmiennictwa wykazano, że większość zmian GA w trakcie terapii biologicznej miała uogólniony charakter, zmienny czas wystąpienia i dobrze odpowiadała na miejscowe lub ogólne glikokortykosteroidy. Większość zmian związana była ze stosowaniem inhibitorów TNF-α, co z jednej strony zwraca uwagę na konieczność obserwacji pacjentów w trakcie leczenia pod kątem rozwoju GA, z drugiej jednak być może stanowi odzwierciedlenie dłuższej dostępności tej grupy preparatów na rynku medycznym w porównaniu do innych leków biologicznych.
Badacze podkreślili, że terapie biologiczne mogą prowadzić do przesunięcia niektórych szlaków immunologicznych i prowadzić do inicjowania zmian GA. Jest to jednak zagadnienie, które wymaga dalszych badań. Ponadto zwrócili uwagę na konieczność regularnych kontroli pacjentów z chorobami zapalnymi mediowanymi immunologicznie, będącymi w trakcie leczenia biologicznego, z uwagi na możliwość rozwoju GA. W tej grupie chorych częstość występowania tego zaburzenia może być zwiększona, co wynika z nadmiernej aktywacji immunologicznej (komórki Th1 i TNF-α), a także ze współwystępujących schorzeń, takich jak wirusowe zapalenie wątroby typu C, cukrzyca, choroby tarczycy.
Lek. Paulina Szczepanik-Kułak
Na podstawie:
Lytvyn Y, Mufti A, Sachdeva M, Maliyar K, Yeung J. Development of granuloma annulare in patients on biologic therapies: A systematic review. J Am Acad Dermatol. 2021 Dec;85(6):1594-1597. doi: 10.1016/j.jaad.2020.11.053. Epub 2020 Nov 28. PMID: 33253852.
Fot. ze zbiorów prof. dr hab. n. med. Andrzeja Kaszuby