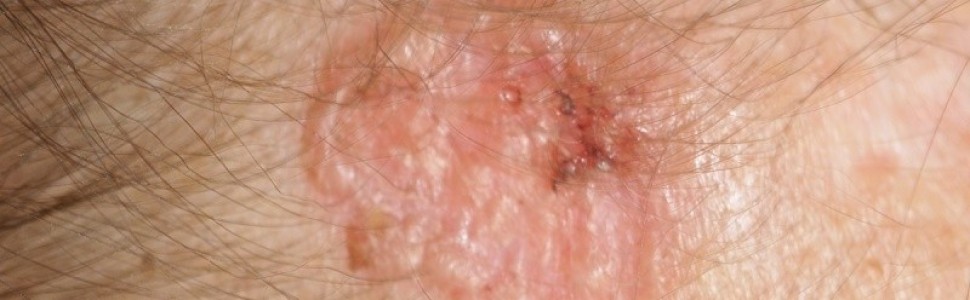
BCC jest najpowszechniej występującym nowotworem, stanowi ok. 80% wszystkich niemelanocytowych raków skóry (non-melanoma skin cancers, NMSC). Rozwija się typowo w lokalizacjach eksponowanych na światło słoneczne, najczęściej na twarzy. Miejscowo zaawansowane BCC mogą naciekać i niszczyć struktury kostne, powodować znaczny defekt kosmetyczny, a także w rzadkich przypadkach dawać przerzuty odległe.
Sonidegib jest kolejnym po vismodegibie (który FDA zaaprobowała w styczniu 2012 roku) inhibitorem szlaku sygnałowego Hedgehog. Szlak ten jest aktywny w rakach BCC. Lek jest przyjmowany w postaci tabletek doustnych 1 raz dziennie. Wskazania do zastosowania sonidegibu obejmują pacjentów z zaawansowanym BCC, u których przeciwwskazane bądź niemożliwe jest leczenie chirurgiczne i radioterapia.
Sonidegib badano w podwójnie zaślepionym badaniu klinicznym na pacjentach z lokalnie zaawansowanym BCC. Pacjentów randomizowano do dwóch grup: przyjmujących 200 lub 800 mg leku na dobę. Obserwowano podobną skuteczność w obydwu grupach, natomiast u chorych przyjmujących 800 mg znacznie częściej obserwowano objawy uboczne. U 58% pacjentów leczonych sonidegibem w dawce 200 mg dziennie obserwowano skurczenie guza lub jego całkowite ustąpienie. Odpowiedź utrzymywała się przez okres od 1,9 do 18,6 miesiąca, przy czym u połowy pacjentów trwała co najmniej 6 miesięcy.
Do najczęściej obserwowanych objawów niepożądanych należały: skurcze mięśniowe, utrata włosów, zaburzenia czucia smaku, męczliwość, nudności, wymioty, bóle głowy, bóle mięśniowe, biegunka, spadek masy ciała, spadek apetytu, bardzo rzadko rabdomioliza. Z powodu teratogennego działania leku wydano specjalne ostrzeżenie dotyczące zakazu podawania sonidegibu u pacjentek ciężarnych. Konieczne jest stosowanie skutecznej antykoncepcji u kobiet i mężczyzn przyjmujących lek.
Źródło:
http://www.fda.gov/NewsEvents/Newsroom/PressAnnouncements/ucm455862.htm
http://www.medicalnewstoday.com/articles/297323.php
Lek. Michał Adamczyk
Klinika Dermatologii, Wenerologii i Dermatologii Dziecięcej Uniwersytetu Medycznego w Lublinie